
Садржај
Теоријске перформансе су израз који се користи у хемији да би се описао максималан производ који се очекује у хемијској реакцији. Морате почети са уравнотеженом хемијском једначином и дефинисати ограничавајући реагенс. Мерењем количине реагента који се користи, можете израчунати количину производа. То представља, заузврат, теоретске перформансе једначине. У реалној ситуацији, вероватно ћете имати мали губитак због неефикасности самог експеримента.
Кораци
Метода 1 од 2: Одређивање граничног реагенса
Почните с уравнотеженом хемијском једначином. Хемијска једначина је попут рецепта.Показује да реагенси (на левој страни) реагују на формиране производе (на десној страни). Исправно избалансирана једнаџба показаће количину атома која улази једнака оној реагенса који излазе као производи.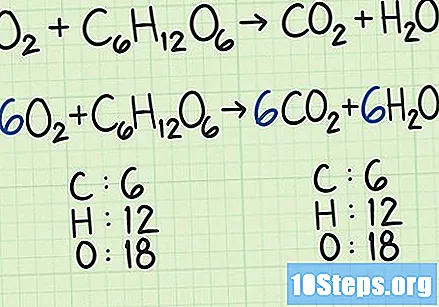
- На пример, размотрите једноставну једначину. Постоје два атома водоника и са леве и са десне стране, али два атома кисеоника улазе као реактанти, а само један напушта крајњи производ са десне стране.
- Да бисте уравнотежили једначину, удвостручите количину производа:.
- Проверите биланс. Овом променом је коригован кисеоник, који сада има два атома на обе стране једначине. Међутим, сада су два атома водоника са леве и четири с десне стране.
- Удвостручите количину водоника у реагенсу. Ово ће прилагодити једначину. Ова размена сада има четири атома водоника са обе стране и два атома кисеоника. Једнаџба је уравнотежена.
- У мало компликованијем примеру, кисеоник и глукоза могу да реагују и формирају угљен диоксид и кисеоник:. У овој једначини, свака страна има тачно шест атома угљеника (Ц), 12 водоника (Х) и 18 кисеоника (О). Једнаџба је уравнотежена.
- Прочитајте овај водич ако желите знати више о уравнотежењу хемијских једначина.

Израчунајте моларну масу сваког реагенса. Помоћу периодичне табеле или другог референтног извора потражите моларну масу сваког атома укључених једињења. Додајте их заједно да бисте пронашли моларну масу сваког једињења реагенса, правећи га за појединачне молекуле. Размотрите поново једнаџбу која претвара кисеоник и глукозу у угљен диоксид и кисеоник:.- У овом примеру, молекула кисеоника () садржи два атома кисеоника.
- Моларна маса атома кисеоника је приближно 16 г / мол (ако је потребно, могу се наћи и прецизније вредности).
- Два атома кисеоника × 16 г / мол по атому = 32 г / мол
- Други реагенс, глукоза (), има моларну масу једнаку
. - Да бисте детаљније прегледали овај корак, можете прочитати водич о томе како израчунати моларну масу.

Претворите количину сваког реагенса из грама у молове. У реалној ситуацији, знат ћете масу сваког реагента у грамима. Поделите ову вредност са моларном масом једињења да бисте је претворили у молове.- Претпоставимо, на пример, да сте почели са 40 грама кисеоника и 25 грама глукозе.
- .
- .
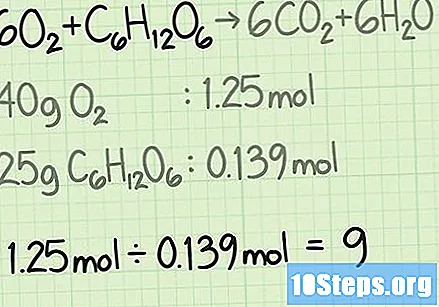
Одредите пропорцију реагенса. Мол је алат који се користи у хемији за бројање молекула на основу њихове масе. Када одређујете количину молова кисеоника и глукозе, знаћете колико молекула је започело. Да бисте израчунали однос између два, поделите број молова једног реагенса на број мола другог.- У овом примеру почињете са 1,25 молова кисеоника и 0,139 молова глукозе. Дакле, стопа кисеоника у односу на глукозу биће. Овај омјер значи да ћете имати девет пута више молекула кисеоника од молекула глукозе.
Пронађите идеалан омјер реакције. Придржавајте се једначне уравнотежене реакције. Коефицијент пре сваког молекула указује на брзину молекула потребну за реакцију. Ако користите тачно брзину наведену у овој формули, оба реагенса морају се користити подједнако.
- У овој једначини, реагенси су дати као. Коефицијенти показују да је за сваки молекул глукозе потребно шест молекула кисеоника. Идеални омјер у овом случају ће бити једнак.
Упоредите стопе да бисте пронашли ограничавајући реагенс. У већини хемијских реакција, један од реагенса ће се потрошити пре осталих. Она која се прво користи назива се ограничавајућим реагенсом. Он одређује колико дуго може да се догоди хемијска реакција и теоријски принос који се очекује. Упоредите две стопе израчунате да бисте идентификовали ограничавајући реагенс: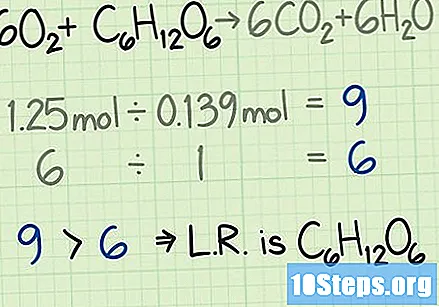
- У овом примеру почињете са девет пута више кисеоника него глукозе када мерите количину молова. Формула указује да је идеална пропорција једнака шест пута већој количини кисеоника у односу на глукозу. Дакле, имате више кисеоника него што вам је потребно. Други реагенс, у овом случају глукоза, биће ограничавајући реагенс.
Метода 2 од 2: Одређивање теоријског приноса
Поново анализирајте реакцију да бисте добили жељени производ. Десна страна хемијске једначине показује производе настале реакцијом. Коефицијенти сваке, у уравнотеженој реакцији, указују на вашу количину која се очекује у молекуларним пропорцијама. Сваки производ има теоретски принос, који указује на количину производа за који се очекује да ће бити добијен у савршено ефикасној реакцији.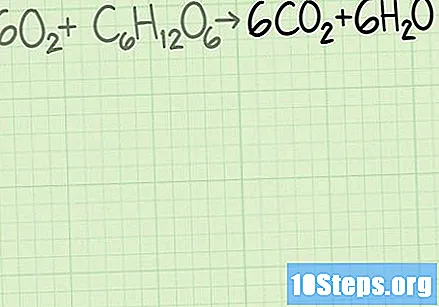
- Настављајући горњи пример, анализираћете реакцију. Два производа приказана на десној страни су угљендиоксид и вода.
- Можете започети са било којим од производа у прорачуну теоријског приноса. У неким случајевима ће забринутост постојати само у вези с једним од производа. У тој ситуацији, са овим ће се почети.
Забиљежите мол молекуле ограничавајућег реагенса. Увек треба да упоређујете молску количину реагенса и молну количину производа. Ако упоређивање узме у обзир масу обоје, ваш резултат неће бити тачан.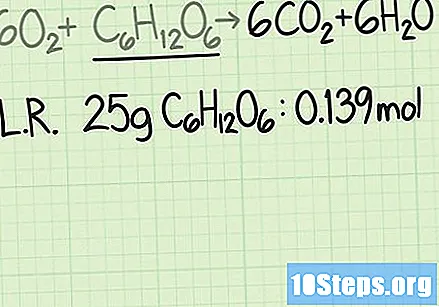
- У горњем примеру, глукоза је ограничавајући реагенс. Прорачуном моларне масе утврђено је да је почетних 25 грама глукозе еквивалентно 0,139 мола глукозе.
Упоредите брзину молекула у производу и реагенсу. Вратите се уравнотеженој једначини. Поделите жељени број молекула према броју молекула ограничавајућег реагенса.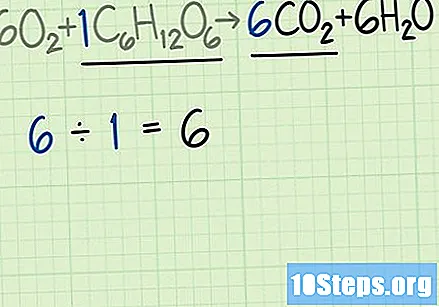
- Балансирана једначина, у овом примеру, биће. Ова једначина указује да се може очекивати добијање шест молекула жељеног производа, угљен диоксида (), за сваки молекул глукозе ().
- Однос угљен-диоксида и глукозе је. Другим речима, ова реакција може да произведе шест молекула угљен-диоксида за сваки молекул глукозе.
Помножите количину са количином ометајућег реагенса у молима. Одговор ће бити еквивалентан теоријском приносу жељеног производа у кртицама.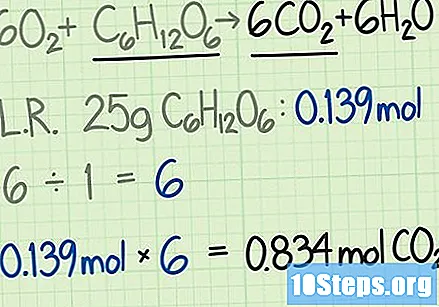
- У овом примеру, 25 грама глукозе еквивалентно је 0,139 молова глукозе. Однос угљен-диоксида и глукозе биће 6: 1. Може се очекивати да ће добити шест пута већу количину молова угљен-диоксида у односу на почетну глукозу.
- Теоретски принос угљен диоксида биће једнак
.
Претворите резултат у граме. Ово је обрнути корак од претходног, у израчунавању количине молова или реагенса. Када знате колико молова можете очекивати, помножит ћете се са моларном масом производа да бисте одредили теоретски принос у грамима.
- У овом примеру је моларна маса од око 44 г / мол (моларна маса угљеника је -12 г / мол, а кисеоника, око 16 г / мол, укупно).
- Помножите 0.834 мола од. Теоретски принос експеримента биће једнак 36,7 грама.
По жељи поновите израчун за други производ. У неколико експеримената можда ћете бити забринути само перформансама производа. Ако желите да пронађете теоретске перформансе оба, само поновите поступак.
- У овом примеру, други производ је вода, или. Према уравнотеженој једначини, очекује се да се из шест молекула глукозе добије шест молекула воде. То је однос 1: 1. Дакле, када почнете са 0,139 молова глукозе, на крају ћете добити 0,139 мола воде.
- Помножите количину мола воде са моларном масом. Моларна маса ће бити једнака. Множењем производа добиће се резултат. Теоретски принос воде у овом експерименту биће једнак 2,50 грама.


