Садржај
Иако сви атоми истог елемента садрже исти број протона, број неутрона може варирати. Знајући колико неутрона садржи одређени атом може вам помоћи да утврдите да ли је честица правилна у том елементу или изотопу, који ће имати више или мање неутрона. Одређивање броја неутрона у атому је прилично једноставно и не захтева експеримент. Да бисте израчунали број неутрона у регуларном атому или изотопу, следите та упутства са периодичном табелом у руци.
Кораци
Метода 1 од 2: Проналажење броја неутрала у заједничком атому
Пронађите елемент у периодној табели. За овај пример, погледајмо ОС (Ос), који се налази у шестом реду, од врха до дна.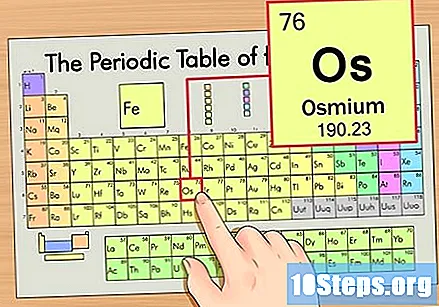
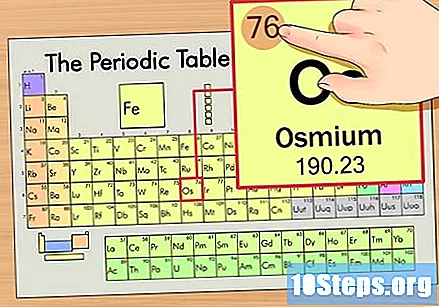
Пронађите атомски број елемента. То је обично највидљивији број за одређени елемент и обично је изнад његовог симбола (у табели коју користимо у ствари није наведен други број). Атомски број је број протона у једном атому тог елемента. Број Ос је 76, што значи да Осмијум атом има 76 протона.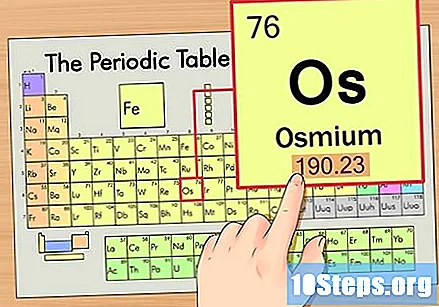
Пронађите атомску тежину елемента. Овај број се обично налази испод атомског симбола. Имајте на уму да се табела у овом примеру заснива само на атомском броју и не наводи атомску тежину. То неће увек бити случај. Осмијум има атомску тежину од 190,23.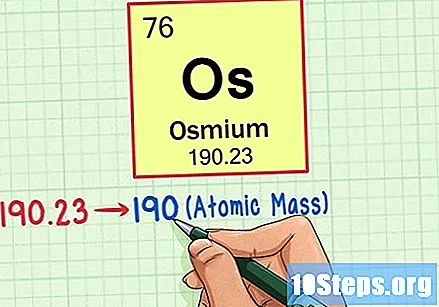
Заокружите атомску тежину на најближи цели број да бисте пронашли атомску масу. У нашем примеру 190,23 би био заокружен на 190, што би резултирало атомском масом од 190 за Осмијум.- Атомска маса је просек изотопа елемента. Према томе, обично није цео број.
Одузми атомски број од атомске масе. Пошто се велика већина масе атома налази у његовим протоновима и неутралима, одузимањем броја протона (то јест, атомског броја) од атомске масе добићете број израчунато неутрона у атому. Број иза децималне тачке обично представља врло малу масу електрона у атому. У нашем примеру то је: 190 (атомска маса) - 76 (број протона) = 114 (број неутрона).
Запамтите формулу. Да бисте у будућности пронашли број неутрона, само користите ову формулу: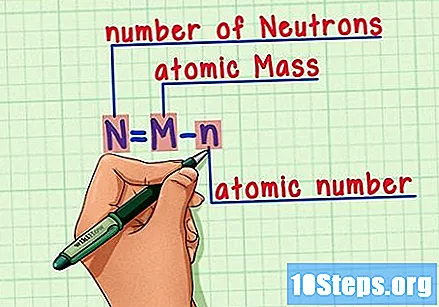
- Н = М - н.
- Н = број Неутронс.
- М = Матомско печење.
- н = натомски хумерус.
- Н = М - н.
Метода 2 од 2: Проналажење броја неутрона у изотопу
Пронађите елемент у периодној табели. На пример, хајде да користимо изотоп угљеник-14. Пошто је неизотопски облик угљеника-14 једноставно угљеник (Ц), пронађите овај елемент у периодној табели (у другом реду).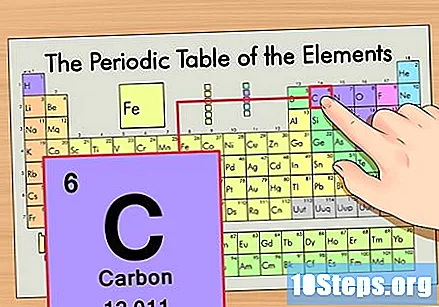
Пронађите атомски број елемента. То је обично највидљивији број за одређени елемент и обично је изнад његовог симбола (у табели коју користимо у ствари није наведен други број). Атомски број је број протона у једном атому тог елемента. Ц је број 6, што значи да атом угљеника има 6 протона.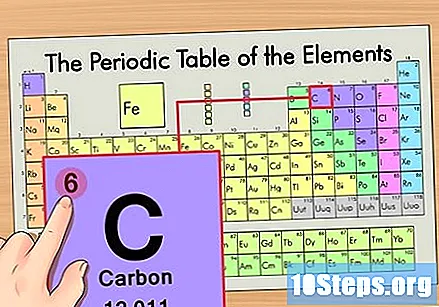
Пронађите атомску масу. Ово је невероватно лако са изотопима, како су они добили име по својој атомској маси. Угљик-14 има атомску масу 14. Једном када пронађете атомску масу изотопа, поступак проналаска броја неутрона је исти као и код обичних атома.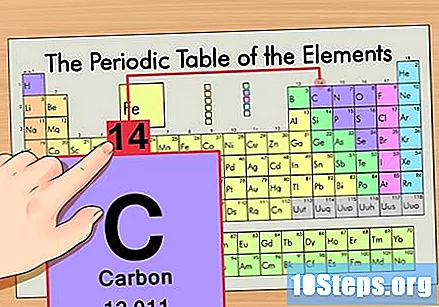
Одузми атомски број од атомске масе. Пошто се велика већина масе атома налази у његовим протоновима и неутралима, одузимањем броја протона (то јест, атомског броја) од атомске масе добићете број израчунато неутрона у атому. Број иза децималне тачке обично представља врло малу масу електрона у атому. У нашем примеру то је: 14 (атомска маса) - 6 (број протона) = 8 (број неутрона).
Запамтите формулу. Да бисте у будућности пронашли број неутрона, само користите ову формулу: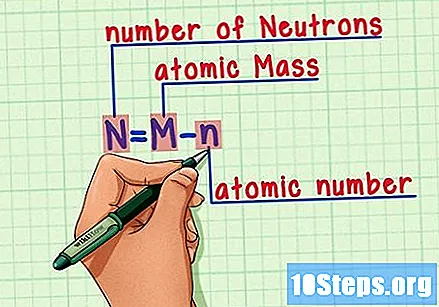
- Н = М - н.
- Н = број Неутронс.
- М = Матомско печење.
- н = натомски хумерус.
- Н = М - н.
Савети
- Осмијум, чврсти метал на собној температури, име је добио од грчке речи за "мирис", "осме".
- Протони и неутрони чине скоро целу масу елемената, док електрони и друге разнолике честице представљају занемарљиву масу (приближавајући се нултој маси). Пошто је протон приближно исте тежине као и неутрални, а атомски број представља број протона, једноставно можемо одузети број протона од укупне масе.
- Ако нисте сигурни који је број који се налази у периодичној табели, само запамтите да се обично прави око атомског броја (то јест, броја протона), који почиње са 1 (Водоник) и прелази једну јединицу по лево десно, завршавајући са 118 (Унуноцтио). То је зато што број протона у атому одређује шта је тај атом, олакшавајући организовање елементарних карактеристика (на пример, атом са два протона ће увек бити хелијум, баш као што ће други атом са 79 протона увек бити злато).